

Símbolo
Si
Nombre: Silicio
Número Atómico: 14
Masa Atómica: 28.086

Estado de agregación: Sólido
Punto de ebullición, °C: 2355
Punto fusión, °C: 1410
Electronegatividad: 1.9
Estados Oxidación: +4, 2
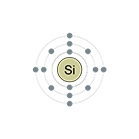
Configuración electrónica: [Ne]3s23p2
El silicio amorfo es un polvo pardo, químicamente más activo que el silicio cristalino.
La variedad cristalina, de color gris oscuro, tiene una estructura similar a la del diamante y es extremadamente duro.
Mediante aluminotermia a partir de la sílice (óxido de silicio) y posterior tratamiento con ácido clorhídrico.
Reducción de sílice con carbono o carburo de calcio en un horno eléctrico con electrodos de carbono.
Reducción de tetracloruro de silicio con hidrógeno (para obtenerlo de forma muy pura).
El silicio hiperpuro se obtiene por reducción térmica de triclorosilano (HSiCl3) ultra puro en atmósfera de hidrógeno y posterior fusión por zonas a vacío.

Para fabricar chips para computadoras.
El silicio dopado con boro, galio, fósforo o arsénico se emplea para la fabricación de transistores, rectificadores y otros dispositivos electrónicos.
En células fotovoltaicas para la conversión de energía solar en eléctrica.
En aleaciones con aluminio, magnesio o cobre da mayor resistencia.
Algunos de sus compuestos se usan en la fabricación de ladrillos y hormigón (materiales refractarios), de detergentes, como agente desecante, como soporte para catalizadores, en cromatografía y como aislante térmico.
Como polímeros se utilizan para fabricar juguetes, lubricantes, películas impermeables o implantes.
La sílice (arena) es el principal ingrediente del vidrio, uno de los materiales más baratos con excelentes propiedades mecánicas, ópticas, térmicas y eléctricas.

Descubierto por Jöns Jacob Berzelius en Suecia en 1824.
El nombre "silicio" deriva del latín "silex" (pedernal).
El nombre de pedernal hace referencia a un material hecho de dióxido de silicio, con el que se fabricaban herramientas y armas, siendo los primeros utensilios del hombre en la prehistoria.
Berzelius obtuvo silicio amorfo al hacer reaccionar tetra fluoruro de silicio sobre potasio fundido.
En 1854, Sainte-Claire Deville preparó silicio cristalino por electrólisis de un cloruro impuro de sodio y aluminio.